幹細胞からエクソソームへ、再生医療の最前線では

最近エクソソームが、大きな注目を集めています。再生医療の主役は長らく幹細胞でしたが、エクソソームにその座を奪われつつあるのです。
その背景にある再生医療の歩みともいえる長いストーリーについて解説いたしましょう。
人体の仕組みから幹細胞の役割、幹細胞に注目することで再生医療が大きく発展したこと、ES細胞やiPS細胞の登場と挫折と順を追って説明していきます。少し長くなりますがお付き合いください。

細胞のダイナミクスとは 人間の生命の根本について
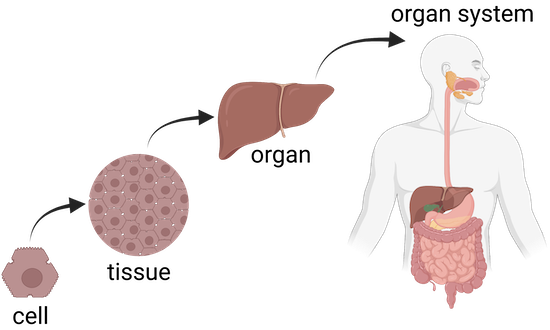
人間の体は約200種類の細胞で構成されており、その総数は30~40兆個です1)。これらの細胞は、その構造、機能、体内の位置などがそれぞれ違います。
細胞は大きく分けると、上皮細胞、筋肉細胞、神経細胞、結合組織細胞の4種類。人間を含む生物の体は、細胞が集まって生命維持に不可欠な臓器や組織を形成しています。
細胞にはそれぞれ寿命があり、その寿命は細胞の種類や働きによって大きく異なっていますが、細胞ごとに寿命の長さが違う理由はまだ解明されていません。
引用元:Khan Academy
細胞の入れ替わりが人間の生命維持のカギ
たくさんの細胞の集合体である私たちの体の中では、常に細胞が入れ替わっています。
古くなったり傷ついたりした細胞が(アポトーシス、ネクローシス、オートファジーなどのプロセスを経て)死滅し、それに代わる新しい細胞が作られているのです。
細胞が死滅するプロセスは、健康な組織を維持するためには不可欠で、細胞の入れ替わり速度は、細胞の種類によって大きく異なります。
例えば、腸を覆う腸上皮細胞の寿命はわずか数日ですが、脳の神経細胞は一生。私が専門とする皮膚の細胞は約2週間で入れ替わります。
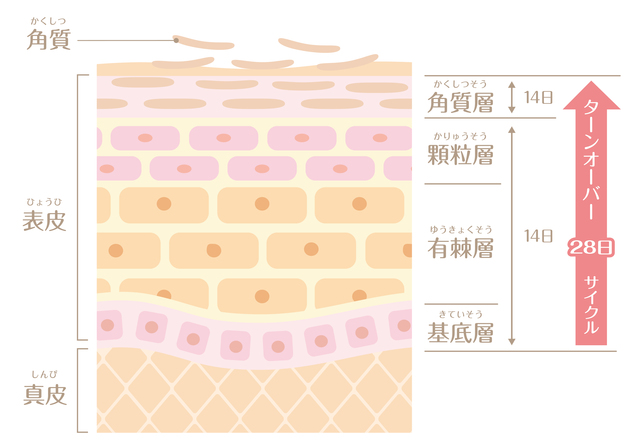
細胞死と細胞生産のバランスは、全身の健康や組織の恒常性を維持するために非常に重要なのです。
ヘイフリック限界と寿命
人間の寿命は理論上120年という話を聞いたことがあるでしょうか。これは、細胞を再生する能力には上限があるという考えに基づいています。
この考え方は、ヒトの細胞が試験管内で一定の回数(約40~60回)しか分裂・複製できないことを発見したレナード・ヘイフリック博士の「ヘイフリック限界」、といわれるもの2)です。
この限界に達すると、細胞は老化状態に入り、分裂しません。
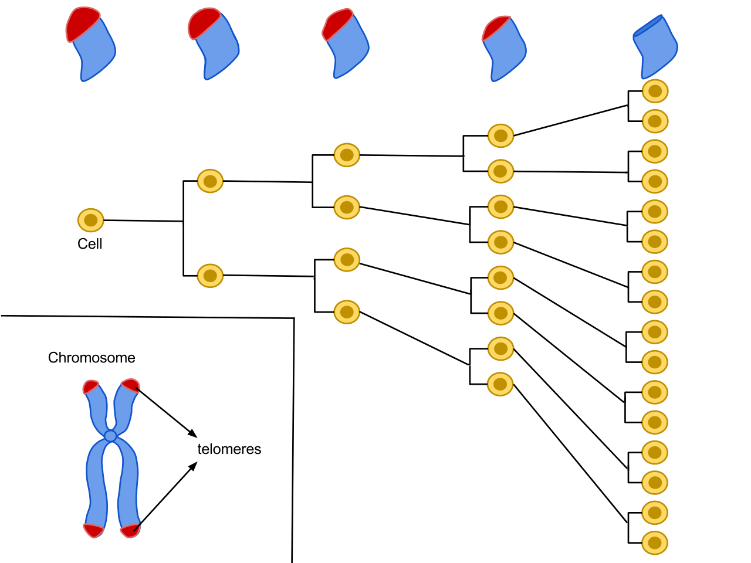
がんや脳血管障害、心筋梗塞などの命にかかわる大病にならず、かつ不慮の事故に遭わなかったら、ヒトは理論的には120歳まで生きられるはずなのです。
そして誰もが健康に120歳まで生きられるにはどうすればよいのか?というのは再生医療やアンチエイジングの最も大きなゴールのひとつ、と言われています。
細胞の入れ替わりと幹細胞
人間が生きている間ずっと古くなったり傷ついたりした細胞が死んで新しい細胞が生まれ、膨大な数の細胞(約30兆~40兆個)が絶えず入れ替わっています。
細胞の入れ替わりは、体の組織や臓器の健康、機能、恒常性を維持するために不可欠。細胞の入れ替わりができなくなるのは死を意味するのです。
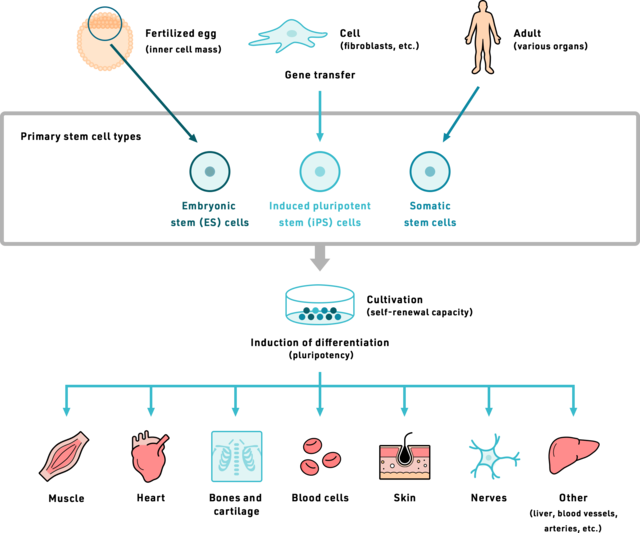
絶えず続く細胞の入れ替わりにおいて、幹細胞は重要な役割を担っています。幹細胞は、さまざまな細胞へと成長する能力を持つ未分化な細胞です。
分化とは、幹細胞が特定の役割や機能を持つ細胞へと成長する過程のこと。分化の過程では、幹細胞は特定の遺伝子の活性化や不活性化を起こし、筋肉や皮膚の細胞などそれぞれ個性を持った細胞に変化します。
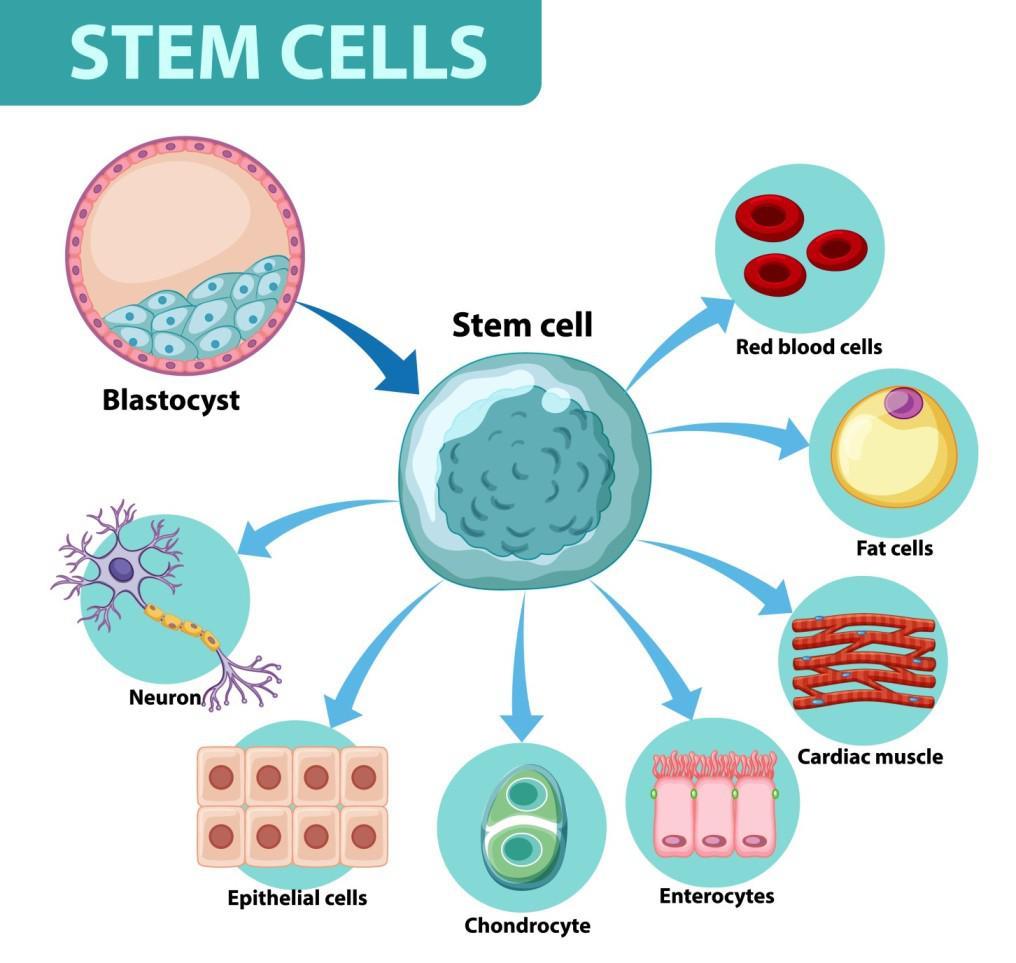
多能性幹細胞と組織幹細胞
幹細胞は大きく2種類に分けられます。
多能性幹細胞(Puripotent stem cell):体内のあらゆる細胞種に分化することができる幹細胞です。
組織性幹細胞(tissue stem cell): 皮膚や血液のように、特定の臓器や組織で、消えた細胞のかわりを造り続けている幹細胞で、体性幹細胞とも呼ばれます。特定の組織や臓器内で特定の種類の細胞しか作れないため、分化の可能性がより限定された細胞です。
引用元:SanBio
そして、人工的に作り出された多能性幹細胞が、ES細胞とiPS細胞(人工多能性幹細胞)です(こちらについては後で詳しく説明)。
組織幹細胞は、全身のほとんどの組織や臓器に存在し、細胞の再生と修復に寄与しています。
これらの幹細胞は、それぞれの組織に存在する特定の細胞型に分化することができ、失われた細胞や損傷した細胞を置き換えることが可能です。
例えば、皮膚では、表皮と毛包に存在する幹細胞が、皮膚細胞の絶え間ない入れ替えや髪の成長に貢献。
血液では、骨髄に存在する造血幹細胞が、赤血球、白血球、血小板などの新しい血球を生成する役割を担っています。
このように幹細胞は、人間の一生を通じて、細胞の入れ替わりと再生が絶えず行われ、体の組織や臓器が適切に機能し、維持されるために大きな役割を果たしているのです。
受精卵から人間へ、細胞分化の驚異
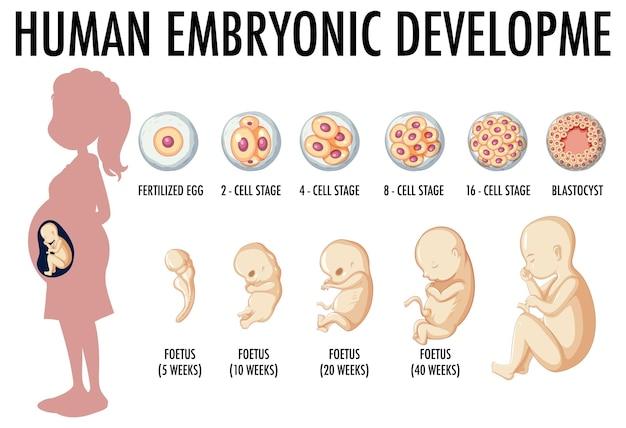
驚くべきことですが、私たちの体をかたち作る細胞は、元をたどればたった一個の受精卵。受精卵は分裂を繰り返しながら私たちの体のすべての細胞を作り出すのです。
受精卵が分裂を続けていく中で、その中でひとつひとつの細胞は自分がどんな役割を持った細胞になるかが決まっていきます。先ほども登場しましたが、これが分化です。
神経、筋肉、皮膚、血液など役割が決まると、細胞はそれに合った形や機能に変化し、適切な場所に収まっていきます。
母親の子宮内で受精卵の分化が進み、それぞれの細胞が自分の役割を果たせるようになると、胎児は赤ちゃんとして、この世に生まれてくるのです。
しかし、胎児や赤ちゃんの体の中には役割がまだ決まっていない細胞、つまり未分化細胞(幹細胞)がたくさんあります。
例えば、転んで顔を擦りむいたとき、大人だと治るのに1週間くらいはかかり、傷跡もしばらく残りますが、赤ちゃんだと擦り傷くらいならあっという間に治ってしまい、傷跡もすぐに消失。
それは、赤ちゃんの体にたくさんある幹細胞が回復を促すからです。
ES細胞とiPS細胞:人工的に作り出された多能性幹細胞
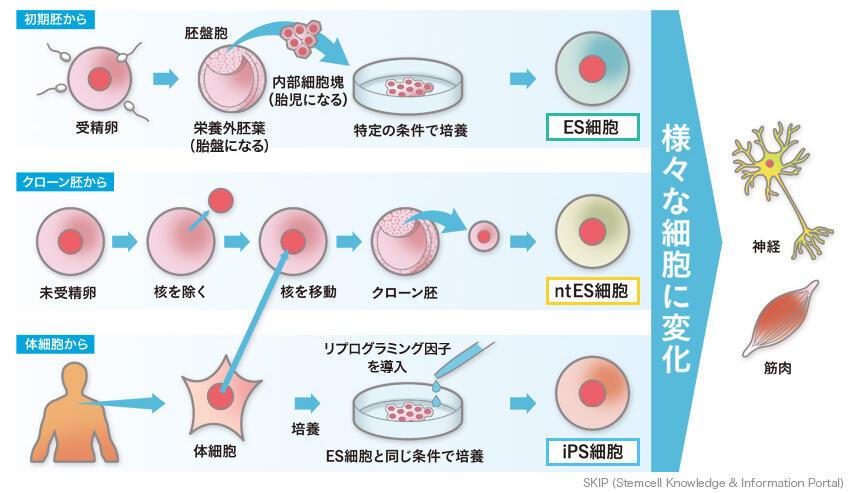
ES細胞(Embryonic Stem cell)とiPS細胞(induced Pluripotent Stem cell)は、人工的に作られた多能性幹細胞で、体内のあらゆる細胞種に分化する可能性を持っています。
ES細胞とは?
ES細胞は、胚性幹細胞とも言われます。胚とは受精卵が数回分裂して、100個程度の細胞の塊になったもの。この胚の内部にある細胞の塊を取り出して培養したものがES細胞です。
ES細胞は、胚外組織を除く体内のあらゆる細胞種に分化する能力を持つ多能性幹細胞であり、再生医療への応用が期待されています。
ES細胞の持つ弱点① 倫理的な問題
しかし、胚は新生児に育つ可能性を持つため、この胚から培養されるES細胞には倫理的な問題が常に付きまとうのです。
ES細胞に関する倫理的な問題には以下のようなものがあります。
胚はヒトそれともモノ?
胚を人間の生命と見なすべきかどうかについては議論が分かれています。生命は受胎から始まると考える人もおり、幹細胞を得るために胚を破壊することは道徳的・倫理的に許されないと考える人も多いです。
一方で初期段階の胚は、完全に発達した人間と同じような道徳的観念を持つものではなく、ES細胞を用いた研究や治療がもたらす潜在的な利益は、その懸念に勝るものであると主張する人もいます。
搾取と商業化
幹細胞研究や治療の商業化が、特に研究目的の胚作成のための卵子提供の場合、弱い立場の人々の搾取につながることが懸念されるのです。
このような倫理的な問題からES細胞の研究や治療利用は、各国が法律で厳しく規制しています。
ES細胞と法規制
日本では、ES細胞の研究は主に、「生命倫理に関する指針」および「人間の胚性幹細胞の取扱いに関する指針」によって規制されています。
<生命倫理に関する指針>
2000年に策定され、その後改訂された「生命倫理に関する指針」は、生命科学研究における倫理的問題に触れています。この指針は、胚性幹細胞研究の研究者が人間の尊厳を尊重し、透明性、公正性、責任を持って研究を行うことを求めているもの。
<人間の胚性幹細胞の取扱いに関する指針>
2001年に制定された「人間の胚性幹細胞の取扱いに関する指針」は、胚性幹細胞研究に対する具体的な規制を定めています。主な内容は以下の通りです。
研究目的: 研究は、再生医療や疾患治療に関連する目的で行われるべきである。
提供された胚の利用: 不妊治療で使われなかった余剰胚のみが、提供者の同意を得た上で使用されるべき。
胚の年齢制限: 胚の取得は、受精後14日以内でなければいけない。
報酬の禁止: 胚の提供者に対する金銭的報酬は禁止。
クローニングの禁止: 人間のクローニングを目的とした研究は禁止されています。
ES細胞のもつ弱点②拒絶反応の問題
ES細胞はレシピエント(受け手)と遺伝的に異なる胚に由来するもの、つまり他人由来のものなので拒絶反応の問題が。
拒絶反応はES細胞を投与された側の人の免疫系が他人由来のES細胞を異物と認識し、攻撃することで起こります。
この問題は、免疫拒絶反応または移植拒絶反応と呼ばれ、ES細胞を再生医療や移植療法に用いる際の大きな課題です。
ES細胞のこれらのデメリットを解決する全く新しい人工多能性幹細胞として華々しく登場したのが、2008年に京都大学の山中伸弥教授らが発見したiPS細胞。
引用元:日本再生医療学会
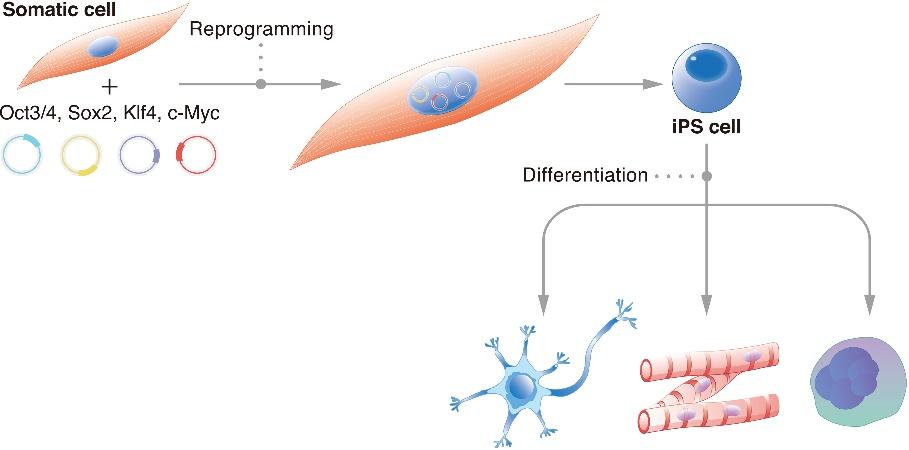
iPS細胞の革命的発見と山中メソッド
iPS細胞は、皮膚や血液などの成人の体細胞に由来する幹細胞の一種で、成人の体細胞を体内のあらゆる細胞種に分化できる胚性幹細胞のような状態に再プログラムすることで作られます3)。
このプロセスでは通常、細胞のアイデンティティを「リセット」。これは、多能性を誘導する特定の転写因子のセットを導入ことによって行われます。
この細胞をリセットする方法が山中メソッド。もちろん山中伸弥先生にちなんで名付けられたものです。
2006年、山中教授の研究チームは、4つの転写因子(Oct3/4、Sox2、Klf4、c-Myc)を導入することで、成体マウス線維芽細胞を多能性幹細胞に再プログラムできることを発見しました4)。
その後、同じ方法をヒトの細胞にも適用することに成功しています。
iPS細胞は、患者さん自身の細胞からつくられるので、ES細胞のような倫理的問題や拒絶反応のリスクはありません3)。
患者さんに特異的な細胞の作製に利用できるため、再生医療の分野で大きな可能性を秘めているのです5)。
iPS細胞は、神経疾患、心血管疾患、代謝性疾患など、さまざまな疾患の研究に使用されています4)。
特定の遺伝子変異や疾患を持つ患者さんからiPS細胞を作製することで、研究者はこれらの疾患の根底にある分子メカニズムを研究し、治療法を検証5)。
また疾患研究に加え、iPS細胞はそれ自体が治療薬として使用できるのではないか、と大きな期待が寄せられています。
すでに、iPS細胞からニューロン、心筋細胞、肝細胞など、いくつかの種類の細胞を作り出すことに成功3)。
これらの細胞は、神経変性疾患から心不全や肝疾患に至るまで、さまざまな疾患の治療に利用できる可能性があります5)。
引用元:JMA
iPS細胞研究の課題
iPS細胞を臨床現場で広く活用するためには、まだまだ解決すべきいくつかの課題が残されています。その一つは、腫瘍形成のリスク。
初期の山中メソッドで、細胞を再プログラムするためにc-Mycなどのがん遺伝子を使用していたのは有名な話です4)。
がん遺伝子の使用を避け、腫瘍形成のリスクを低減する代替的なiPS細胞作製法を開発が進められています5)が、iPS細胞作製の過程で遺伝子に傷がついてしまい、がん化や腫瘍化するリスクはまだ払拭できていません。
iPS細胞利用の法律と倫理、安全性確保と適切な研究の推進にむけて
iPS細胞の使用に関しても、日本は法律で厳しく規制されています。
主に「再生医療等の安全性確保等に関する法律」(再生医療法)と「人の幹細胞等の取扱い及び適正な研究の推進に関する法律」(幹細胞研究推進法)です。
<再生医療法>
再生医療法は、再生医療の安全性を確保し、患者への適切な提供を目的としています。この法律では、iPS細胞を含む再生医療製品の製造・販売・使用に関する基準や手続きを規定。
製品によっては承認を受ける必要があり、また、細胞を移植する際の安全性や品質管理についても規定が設けられています。
<幹細胞研究推進法>
幹細胞研究推進法は、人の幹細胞(iPS細胞を含む)を用いた研究を適正に推進するための法律。この法律は、研究施設に対して、研究目的・方法・倫理審査の手続きなどについての基準を設定。
また、研究における適切な取扱いや透明性の確保を目的として、研究情報の公開が求められています。
これらの法律により、iPS細胞の使用に関する安全性や倫理性が確保され、適切な研究が推進されることになるでしょう。
ただし、技術の進展や新たな課題に対応するため、今後も法律やガイドラインの見直しや改正が行われる可能性はあります。
iPS細胞の再生医療分野での臨床応用が期待されていますが、まだまだ発展途上であり広く一般の人が恩恵を受けるまでには長い時間がかかりそうです。
新たな再生医療のアプローチ、幹細胞上清液とエクソソームの利点と展望
これまで再生医療の主役は、ES細胞やiPS細胞などの幹細胞を利用するものでした。
ですが、ES細胞やiPS細胞は倫理的な問題や拒絶反応の問題、がん化のリスクなどの課題を抱えており、臨床応用はまだまだ先の話となりそうです。
そこで、注目を集めるようになったのが幹細胞培養上清液やエクソソームなどの幹細胞を使わない再生医療。
どちらも倫理的な問題や拒絶反応の問題、がん化のリスクといった幹細胞治療の問題点をクリアしています。
また、幹細胞培養上清やエクソソームは、生きた細胞よりも管理、保管、輸送が容易であり、凍結保存や凍結乾燥が可能であるため、臨床での利用や品質管理がしやすいというメリットが6)。
ES細胞やiPS細胞は厳しい法規制やコスト面においても一般の人がその恩恵にあずかるのは難しい状況ですが、幹細胞上清液やエクソソームはより大量に、より低コストで製造することができます。
より実用的で費用対効果の高い選択肢となりえるでしょう6)。
幹細胞培養上清液とは?
幹細胞培養上清液は、幹細胞が試験管内で成長・増殖する際に放出する成長因子、サイトカイン、エクソソームなどを豊富に含む液体培地です7)。
これらの生理活性分子は損傷した組織の再生を促す力があることがわかってきて、幹細胞培養上清液は再生医療における有望なもの、と期待されています8)。
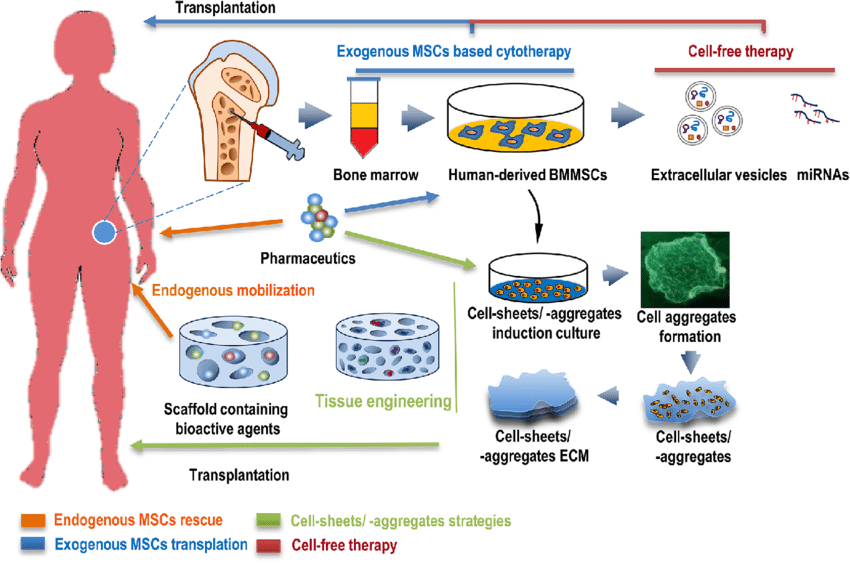
幹細胞培養上清液の調製法
幹細胞培養上清液の調製プロセスは、制御された環境下で幹細胞を培養することから始まります。これらの細胞は通常、ウシ血清を使用した栄養豊富な培地で培養。
そして温度を変えたり、酸素濃度を変えたり、振動を加えたりといったストレスを幹細胞に与えます。
危機を感じた幹細胞は、自分を守るために成長と分裂に必要な必須栄養素や生理活性物質をたくさんうみ出し7)、その中にはサイトカインやエクソソームも。
幹細胞が十分培養されると培養液を回収。培養液は遠心分離器にかけられ、残留する細胞や不純物が取り除かれます9)。
そうして作られるのが、幹細胞培養上清液です。もともとは幹細胞を培養した後に、廃棄物として捨てられていたものでした。
幹細胞培養上清液の中には、さまざまな再生医療への応用が可能な貴重な生理活性分子が含まれていることがわかり、再生医療のために見直されるようになったのです。
再生医療において幹細胞培養上清液を使用するメリット
倫理的な問題がない: ES細胞は胚を原料として作られるため、どうしても倫理的な問題がありますが、幹細胞培養上清液の使用は胚の破壊を伴わないため、倫理的な懸念が緩和されます。
拒絶反応のリスクが少ない:幹細胞培養上清液は細胞ではなく可溶性因子(液体の中に溶け込んでいるタンパク質)で構成されているため、幹細胞を直接移植する場合と比較して、免疫拒絶反応のリスクが低減。
がん化や腫瘍化のリスクが少ない: 幹細胞培養上清液には生きた細胞が含まれていないため、多能性幹細胞移植に伴うがん化や腫瘍化のリスクがありません。
拡張性と費用対効果の向上: 幹細胞培養上清液の製造は、治療目的の幹細胞の生成に比べ、費用効果や拡張性に優れている可能性が。
取り扱いと保管が容易:幹細胞培養上清液は凍結保存や凍結乾燥が可能であるため、臨床での利用がしやすく、品質管理もしやすいとされています。
再生医療において幹細胞培養上清液を使用するメリットには以上のようなものがありますが、幹細胞培養上清液には、汚染の可能性も。
さらに、生理活性物質濃度の厳格な管理の必要性、エクソソームの影響の可能性など、潜在的なリスクや課題があることも認識しておかなければなりません。
これらの懸念に対処し、臨床応用における幹細胞培養上清液の安全性と有効性を確立するためには、さらなる研究が必要です。
幹細胞培養上清液に関連するリスク
幹細胞培養上清液は、再生医療に大きな可能性を持つ一方で、その使用にはいくつかのリスクがあります。
その一つが汚染の可能性です。培養液にウシ血清を使用することにより、病原体やその他の汚染物質が混入する恐れがあります7)。
リスクを最小限に抑えるためには、高品質で病原体を含まないウシ血清を使用し、調製プロセスにおいて厳格な無菌技術を遵守することが欠かせません。
もう一つのリスクは、幹細胞培養上清に含まれる生理活性物質に関連するものです。
生理活性物質は、細胞の成長や組織の再生を制御する上で重要な役割を担っていますが、特定の生理活性物質を過剰に摂取すると、炎症や免疫反応などの副作用を引き起こす可能性があります8)。
安全で効果的な治療のためには、幹細胞培養上清液の組成を注意深く管理し、人体にとって好ましくない生理活性物質が含まれていないことを確認することが不可欠です。
よりシンプルな成分、エクソソームへ
幹細胞から分泌される生理活性物質には人体にとってさまざまな効用がありますが、すべてが人体にとってプラスでないことがわかってきました。
そんな中、よりシンプルな成分として注目を集めるようになってきたのがエクソソームです。
再生医療分野においてエクソソームは幹細胞上清液よりも強力なものとして期待が集まり、世界中で研究が進んでいます。
エクソソームは、細胞から分泌される小さな粒子で、その内部に細胞由来のタンパク質、脂質、DNAなどの遺伝情報を含んでおり、細胞同士はエクソソームをやり取りすることによりコミュニケーションをとっていることがわかってきました10),11)。
私たちの体は30兆を超える細胞で作られており、細胞同士はいろんな手段を用いて常にメッセージをやり取りし、生命を維持しています。そして、エクソソームは細胞間のメッセージ物質として機能。
さらにエクソソームの安定性、低免疫原性、生物学的バリアを越える能力と相まって、組織の修復と再生を促進する能力は、再生医療界で大きな注目を集めています12),13),14)。
エクソソームの利点
いろいろな生理活性物質が混ざった幹細胞上清液とは異なり、エクソソームが発するメッセージはよりシンプルです。
目的をきちんと設定すれば、体内に効率よく情報を伝える能力はエクソソームに軍配があがるでしょう。つまり、よりターゲットをしぼった効果が期待できるのではないかと考えられているのです15),16)。
さらに、エクソソームは幹細胞上清液に比べて副作用の可能性が低く、広く臨床利用されるのではないか、とされています17),18)。
カスタマイズが可能になる?
エクソソームにより、カスタマイズされた再生医療が現実のものになる可能性もあります。
患者由来のエクソソームを分離し、個人のニーズに合わせた治療戦略を立て、治療効果を最大限に高めつつ、副作用を最小限に抑えることができるのではないかと考えられているのです19),20)。
このようにカスタマイズされたアプローチは、さまざまな生理活性物質が混ざった幹細胞上清液では難しいとされています23)。
生物学的バリアも超えるエクソソーム
幹細胞上清と異なるエクソソームのもう一つの利点は、血液脳関門24),25)のような生体関門を通過する能力があることです。
この特性により、これまで届かなかったターゲットに到達することができ、神経変性疾患など、かつて治療不可能と考えられていた疾患の治療に新たな道を開くことができるのでは、と言われています26),27)。
また、エクソソームは幹細胞上清液に比べて安定性が高く、保存、輸送、活性維持が容易28),29)です。
その安定性の高さから、より安全な管理・取り扱いが可能となり、臨床応用に適したものとなり、汚染のリスクも低減されます28),29)。
エクソソームによるアンジエイジング
エクソソームにより期待できる肌のアンチエイジングの可能性やメリットは、以下のようなものがあります。
肌の若返り:エクソソームにより肌の若々しさやみずみずしさを取り戻すことができると考えられています。コラーゲンの生成を促進し、細胞の再生を促すため、小じわやシミが減少する可能性が30)。
抗炎症効果:エクソソームには抗炎症作用があり、ニキビや酒さなど、さまざまな炎症を伴う皮膚疾患に伴う赤み、腫れ、不快感を緩和する可能性があります31)。
創傷治癒:傷や傷跡の治癒プロセスを促進し、肌の質感の向上や傷跡の軽減にも32)。
育毛促進:毛包を刺激し、健康な髪の成長に必要な栄養素を供給することにより、髪の成長を促進することが期待されています33)。
エクソソームに対する期待の声は大きいけれど
エクソソームは、実験室での研究や初期の臨床試験でいい結果が報告されていますが、まだ比較的新しい治療法です34)。そのため、エクソソームの長期的な安全性と有効性に関する研究は限られています。
最も効果的な投与量、投与方法、どんな患者に投与するのが効果的かなど、最適な治療方法を確立するためには、さらなる研究が必要です。
エクソソームを用いた治療については、
でも詳しく紹介しています。
まとめ
私たちの体はひとつひとつの細胞が集まってできていて、生命を維持していくために、細胞は常に新しいものと古いものが入れ替わっています。
その際に鍵となるのが幹細胞であり、幹細胞の働きに人々が注目するようになり、再生医療という概念が生まれたのです。
ES細胞やiPS細胞の発見により、再生医療の世界は希望にあふれたものになると思われました。
ですが、素晴らしい未来の技術であると思われたES細胞やiPS細胞にもさまざまな限界があり、残念ながら現時点では実用段階には至っていません。
そうした中、細胞を使わない再生医療として幹細胞上清液やエクソソームに期待が集まるようになりました。
幹細胞上清液にもメリットはたくさんありますが、ここ数年よりシンプルな成分でできたエクソソームが再生医療の主役となりつつあります。
ただし、エクソソームはまだまだ発展途上のものなので、その点は注意が必要です。
参考文献
1)Bianconi, E., Piovesan, A., Facchin, F., Beraudi, A., Casadei, R., Frabetti, F., … & Canaider, S. (2013). An estimation of the number of cells in the human body. Annals of Human Biology, 40(6), 463-471.
2)Hayflick, L., & Moorhead, P. S. (1961). The serial cultivation of human diploid cell strains. Experimental Cell Research, 25, 585-621.
3)Takahashi, K., & Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126(4), 663-676.
4)Yamanaka, S. (2009). A fresh look at iPS cells. Cell, 137(1), 13-17.
5) Robinton, DA, & Daley, G. Q. (2012). The promise and perils of stem cell therapeutics. Cell Stem Cell, 10(6), 740-749.
6) Phinney, D. G., & Pittenger, M. F. (2017). Concise Review: MSC-Derived Exosomes for Cell-Free Therapy. Stem Cells, 35(4), 851-858.
7) Parekkadan, B., & Milwid, J. M. (2010). Mesenchymal stem cells as therapeutics. Annual Review of Biomedical Engineering, 12, 87-117.
8) Caplan, A. I., & Correa, D. (2011). The MSC: an injury drugstore. Cell Stem Cell, 9(1), 11-15.
9) Phinney, D. G., & Pittenger, M. F. (2017). Concise Review: MSC-Derived Exosomes for Cell-Free Therapy. Stem Cells, 35(4), 851-858.
10) Colombo, M., Raposo, C., & Théry, C. (2014). Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual review of cell and developmental biology, 30, 255-289.
11) Tkach, M., & Théry, C. (2016). Communication by extracellular vesicles: where we are and where we need to go. Cell, 164(6), 1226-1232.
12) Phinney, D. G., & Pittenger, M. F. (2017). Concise review: MSC-derived exosomes for cell-free therapy. Stem cells, 35(4), 851-858.
13) Lener, T., Gimona, M., Aigner, L., Börger, V., Buzas, E., Camussi, G., … & Giebel, B. (2015). Applying extracellular vesicles based therapeutics in clinical trials–an ISEV position paper. Journal of extracellular vesicles, 4(1), 30087.
14) Elahi, F. M., Farwell, D. G., Nolta, J. A., & Anderson, J. D. (2020). Preclinical translation of exosomes derived from mesenchymal stem/stromal cells. Stem cells, 38(1), 15-21.
15) Rani, S., Ryan, A. E., Griffin, M. D., & Ritter, T. (2015). Mesenchymal stem cell-derived extracellular vesicles: toward cell-free therapeutic applications. Molecular therapy, 23(5), 812-823.
16) Xin, H., Li, Y., & Chopp, M. (2014). Exosomes/miRNAs as mediating cell-based therapy of stroke. Frontiers in cellular neuroscience, 8, 377.
17) Robbins, P. D., & Morelli, A. E. (2014). Regulation of immune responses by extracellular vesicles. Nature Reviews Immunology, 14(3), 195-208.
18) Watson, D. C., Bayik, D., Srivatsan, A., Bergamaschi, C., Valentin, A., Niu, G., … & Leppla, S. H. (2016). Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials, 105, 195-205.
19) Vader, P., Mol, E. A., Pasterkamp, G., & Schiffelers, R. M. (2016). Extracellular vesicles for drug delivery. Advanced drug delivery reviews, 106, 148-156.
20) Armstrong, J. P., & Stevens, M. M. (2018). Strategic design of extracellular vesicle drug delivery systems. Advanced drug delivery reviews, 130, 12-16.
21) György, B., Szabó, T. G., Pásztói, M., Pál, Z., Misják, P., Aradi, B., … & Buzás, E. I. (2011). Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cellular and molecular life sciences, 68(16), 2667-2688.
22) Banks, W. A. (2016). From blood-brain barrier to blood-brain interface: new opportunities for CNS drug delivery. Nature reviews drug discovery, 15(4), 275-292.
23) Ha, D., Yang, N., & Nadarajan, P. (2016). Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges. Acta Pharmaceutica Sinica B, 6(4), 287-296.
24) Alvarez-Erviti, L., Seow, Y., Yin, H., Betts, C., Lakhal, S., & Wood, M. J. (2011). Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nature biotechnology, 29(4), 341-345.
25) Kojima, R., Bojar, D., Rizzi, G., Hamri, G. C. E., El-Baba, M. D., Saxena, P., … & Fussenegger, M. (2018). Designer exosomes produced by implanted cells intracerebrally deliver therapeutic cargo for Parkinson’s disease treatment. Nature Communications, 9(1), 1-10.
26) Luan, X., Sansanaphongpricha, K., Myers, I., Chen, H., Yuan, H., & Sun, D. (2017). Engineering exosomes as refined biological nanoplatforms for drug delivery. Acta Pharmacologica Sinica, 38(6), 754-763.
27) Yeo, R. W., Lai, R. C., Zhang, B., Tan, S. S., Yin, Y., Teh, B. J., & Lim, S. K. (2013). Mesenchymal stem cell: an efficient mass producer of exosomes for drug delivery. Advanced drug delivery reviews, 65(3), 336-341.
28) Tang, K., Zhang, Y., Zhang, H., Xu, P., Liu, J., Ma, J., … & Zhao, S. (2012). Delivery of chemotherapeutic drugs in tumour cell-derived microparticles. Nature Communications, 3(1), 1-10.
29) Aqil, F., Kausar, H., Agrawal, A. K., Jeyabalan, J., Kyakulaga, A. H., Munagala, R., & Gupta, R. (2016). Exosomal formulation enhances therapeutic response of celastrol against lung cancer. Experimental and Molecular Pathology, 101(1), 12-21.
30) Oh, M., Lee, J., Kim, Y. J., Rhee, W. J., & Park, J. H. (2018). Exosome-based delivery of super-repressor IκBα relieves sepsis-associated organ damage and mortality. Science Advances, 6(15), eaaz6980.
31) Wang, L., Hu, L., Zhou, X., Xiong, Z., Zhang, C., Shehada, H. M., … & Zhu, H. (2017). Exosomes secreted by human adipose mesenchymal stem cells promote scarless cutaneous repair by regulating extracellular matrix remodelling. Scientific reports, 7(1), 1-14.
32) Zhang, B., Wang, M., Gong, A., Zhang, X., Wu, X., Zhu, Y., … & Jiang, D. (2015). HucMSC-exosome mediated-Wnt4 signaling is required for cutaneous wound healing. Stem cells, 33(7), 2158-2168.
33) Shin, H., Ryu, H. H., Kwon, O., Park, B. S., & Jo, S. J. (2017). Clinical use of conditioned media of adipose tissue-derived stem cells in female pattern hair loss: a retrospective case series study. International Journal of Dermatology, 54(6), 730-735.
34) Colombo, M., Raposo, G., & Théry, C. et al., Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual review of cell and developmental biology, 30, 255-289. 2014



